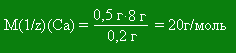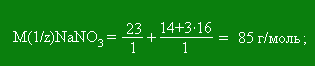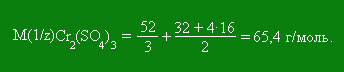Главная | Регистрация | Вход
Главная » » Атомная и молекулярная массы. Эквивалент
14:19 Атомная и молекулярная массы. Эквивалент |
1. Атомная масса. Молекулярная масса Одной из важнейших характеристик атома является его масса. Абсолютная масса атома (т. е. масса выращенная в граммах) величина очень малая. Так атом водорода имеет массой 1,67·10-24 г. Поэтому для практических целей удобнее пользоваться атомной единицей массы (а.е.м.). В качестве 1 а.е.м. принята точно 1/12 часть массы атома изотопа углерода 12С. Атомной массой элемента называется масса его атома выраженная в атомных единицах массы. Иными словами, атомная масса показывает, во сколько раз масса данного атома больше 1/12 массы атома 12С. Так атом азота в 14/12 раза тяжелее атома углерода. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Например М(СО2) = 44 а.е.м. До 1961 года для измерения атомных масс использовалась кислородная единица (к. е.), равная 1/16 атома кислорода. Введение углеродной шкалы атомных масс вместо кислородной связано с различием эталонов физической и химической атомных шкал. При масс-спектроскопических измерениях атомных масс в качестве единицы измерения принималась 1/16 массы изотопа кислорода-16, а в основе химической шкалы была 1/16 средней массы атома природного кислорода, состоящего из смеси изотопов 16О, 17О, 18О. Поэтому величины некоторых констант рассчитанные по физической и химической шкалам были различными. Кроме того изотопный состав природного кислорода также непостоянен. В связи с чем и был осуществлён переход на углеродную единицу. Зная формулу химического соединения, можно рассчитать его молекулярную массу как сумму масс всех входящих в неё атомов. Например: М(H2SO4) = 1·2 + 32 + 16·4 = 98 а.е.м. Широко применяется в химии и единица количества вещества — моль. Моль — это количество вещества содержащее столько структурных единиц (атомов, молекул, ионов, электронов и др.), сколько их содержится в 12 г изотопа углерода-12. Число частиц в одном моле вещества в настоящее время определено с большой точностью — 6,0249·1023. В практических расчетах его принимают равным 6,02·1023. Это число называется Числом Авогадро и обозначается буквой N. Чтобы представить себе, как велико число Авогадро, допустим, что нам удалось пометить все молекулы, содержащиеся в одном моле воды (18 г). Если эту воду вылить в океан и дождаться, когда воды Мирового океана перемешаются, то набрав в любом месте стакан воды, мы найдём в нём примерно 100 меченых молекул. Масса одного моля вещества называется его молярной массой. Молярную массу обычно выражают в граммах на моль (г/моль) или килограммах на моль (кг/моль). Так, М(СаСО3) = 100 г/моль = 0,1 кг/моль. Моль любого вещества содержит одно и тоже число структурных элементов независимо от его химических свойств и агрегатного состояния. Из этого следует, что моль молекул различных газов при одних и тех же условиях занимает одинаковый объём. Этот вывод был подтверждён опытными данными. Объём, занимаемый одним молем газа при нормальных условиях (температура 0 °С, давление 760 мм рт. ст. или 101325 Па) называют мольным объёмом. Он равен 22,4 литра.
2. Закон эквивалентов Закон постоянства состава позволил установить количественные соотношения, в которых различные химические элементы соединяются между собой, Д. Дальтон ввёл в науку понятие о соединительных весах элементов, впоследствии названных эквивалентами. Эквивалентной массой элемента называют такое его количество, которое соединяется единицей (точнее 1,008)массы водорода или с 8 единицами массы кислорода или замещает эти же количества в их соединениях. Теперь эквивалентом элемента называют такое его количество, которое взаимодействует с 1 молем атомов водорода. Например, в соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота и углерода равен соответственно 1, 1/2, 1/3 и 1/4 моль. Масса 1 эквивалента элемента называется эквивалентной массой. В приведённых выше примерах эквивалентная масса хлора равна 35,5 г/моль, серы — 16 г/моль, азота — 4,67 г/моль, углерода — 3 г/моль. Из опытных данных следует, что единица массы водорода эквивалентна (равноценна) 8 единицам массы кислорода, или 16 единицах массы серы или 9 единицам массы алюминия, или 35,5 единицам массы хлора и т. д. Важной характеристикой химического элемента является его валентность. Валентностью называется свойство атомов данного элемента присоединять или замещать в соединении определённое число атомов другого элемента. За единицу валентности принята валентность атома водорода, которая во всех соединениях равна единице. Валентность элемента выражается только целым числом. Величина обратная к валентности называется числом эквивалентности: z = 1/B Валентность, эквивалентная масса и молярная масса связаны соотношением: М(Х) = В·M(1/z)(X). Из этого уравнения следует, что эквивалентная масса элемента можно рассчитать, разделив мольную массу атомов элемента на его валентность. Введение в химию понятия эквивалент позволило сформулировать закон эквивалентов: вещества вступают в реакцию в количествах, пропорциональных их эквивалентам. При решении некоторых задач удобно пользоваться другой формулировкой закона: массы реагирующих веществ пропорциональны их эквивалентным массам. Для определения эквивалентной массы элемента необходимо знать состав его соединения с другим элементом, эквивалентная масса которых известна. Пример. 1. Определим эквивалентную массу и эквивалент кальция, если известно, что при сгорании 0,5 г этого металла образуется 0,7 г оксида. Следовательно оксид содержит 0,5 г металла и 0,2 г кислорода, а эквивалентная масса кислорода 8 г/моль, отсюда: 0,5 г металла взаимодействует с 0,2 г кислорода, а M(1/z)(Ca) взаимодействует c 8 г кислорода
Эквивалент кальция равен 1/2. Пример. 2. Определить M(1/z)(Al) и эквивалент алюминия, зная, что в хлориде алюминия содержится 20,2 % алюминия. Хлор в соединениях с металлами имеет валентность 1, следовательно M(1/z)(Cl) = 35,5 г/моль, отсюда: M(1/z)(Al) соединяется с 35,5 г хлора, а 20,2 г соединяется с 79,8 г
Эквивалент алюминия равен 1/3. Если один элемент образует с другим элементом несколько соединений, то его эквивалентная масса в этих соединениях неодинакова. Например, сера с кислородом образует диоксид серы SO2 и триоксид серы SO3. В первом соединении на 8 единиц массы кислорода приходится 8 единиц массы серы. В триоксиде серы на 8 единиц массы кислорода приходится 5,3 единицы массы серы. Следовательно, в диоксиде серы её эквивалент равен 1/4 моль, а в триоксиде 1/6 моль. Понятие об эквиваленте и эквивалентной массе распространяются и на сложные вещества. Химическим эквивалентом сложного вещества называют такое количество его, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. При решении задач на вычисление эквивалентных масс необходимо иметь в виду следующее: 1) эквивалентная масса оксида равна сумме эквивалентных масс кислорода и элемента, входящего в состав оксида; 2) эквивалентная масса кислоты равна сумме эквивалентных масс водорода и кислотного остатка; 3) эквивалентная масса основания равна сумме эквивалентных масс металла и гидроксильной группы; 4) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка. Для вычисления эквивалентной массы кислоты необходимо разделить её мольную массу на основность кислоты, которая для данной реакции определяется числом атомов водорода, замещающихся металлом. Так, ортофосфорная кислота Н3РО4 в зависимости от условий протекания реакций может быть вступать как одно-, двух- или трёхосновная. Так при образовании дигидрофосфата, гидрофосфата и фосфата эквивалент фосфорной кислоты будет соответствовать 1, 1/2 и 1/3 моль. Чтобы вычислить эквивалентную массу основания, необходимо его молярную массу разделить на кислотность основания, определяемую числом вступающих в реакцию гидроксильных групп. M(1/z)(NaOH) = M(NaOH)/1= 40 г/моль; M(1/z)(Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль. Для соли:
Из приведённых примеров следует, что эквивалентная масса сложного вещества в общем случае не является величиной постоянной, а зависит от химической реакции, в которой принимает участие данное соединение. Если в реакции принимают участие газообразные вещества, пользуются понятием об эквивалентном объёме, т. е. объёме, который занимает при данных условиях один эквивалент газообразного вещества. Так, при нормальных условиях эквивалентный объём водорода равен 11,2 л, эквивалентный объём кислорода — 5,6 л. |
|
|
| Всего комментариев: 1 | ||
| ||